コロナ新薬、広がる選択肢 19日に中外申請の 4例目審議
Nikkei Online, 2021年7月17日 22:41

コロナ薬候補を開発した米リジェネロンの
研究施設(ニューヨーク州)=ロイター
新型コロナウイルス治療薬の選択肢が広がってきた。厚生労働省は19日開く専門部会で、中外製薬が承認を申請している治療薬候補について審議する。承認されれば国内4番目。ワクチン接種が進むものの足元では変異ウイルスによる感染の再拡大が続く。ほかにも複数の候補薬が最終段階の臨床試験(治験)に入っており、医療現場の期待は大きい。
審議されるのは、中外製薬が6月末に製造販売承認を申請した「抗体カクテル療法」だ。米バイオ企業のリジェネロン・ファーマシューティカルズがコロナ治療向けにつくった新薬で、中外の親会社であるスイス・ロシュが開発に協力した。中外は国内での臨床試験や販売を担当する。
抗体カクテル療法は過去に感染し回復した患者から採ったたんぱく質の抗体を、別の抗体に混ぜてつくる。患者には点滴で投与する。「カシリビマブ」「イムデビマブ」と呼ぶこれら2種類の抗体が、ウイルスの表面に結合して増殖を抑える。
米国では2020年11月にリジェネロンが緊急使用許可を取得。軽度から中等度の患者の治療に使われている。ロシュが発表した治験結果によると、入院していない患者に投与したところ、入院または死亡のリスクを約7割減らせたという。
中外は5月、日本政府との間で今年分の供給契約を結んでおり、承認取得後は「速やかに提供できるように準備を進めている」(同社)という。
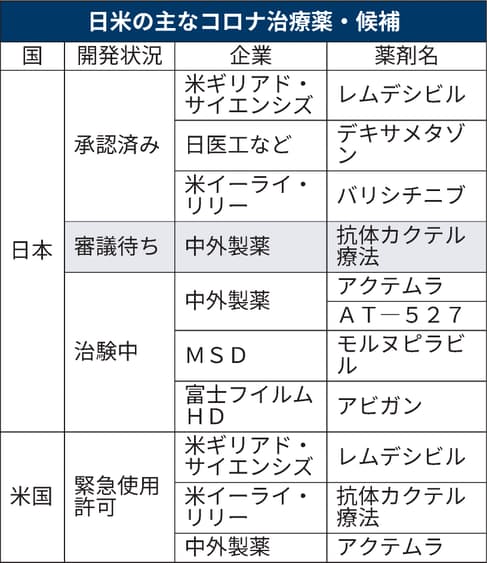
国内ではこれまでに米ギリアド・サイエンシズの抗ウイルス薬「レムデシビル」、日医工などの抗炎症薬「デキサメタゾン」、米イーライ・リリーのリウマチ薬「バリシチニブ」の3種類の治療薬が承認済み。
いずれもほかの病気の治療のために使われてきた薬だが、コロナ治療への転用が認められた。中外が販売をめざす治療薬が承認されれば、新型コロナのためにつくられた新薬で国内での使用が許される第1号となる。
国内では現在、国内外の製薬会社が治療薬の開発を進める。中外はほかにリウマチ薬「アクテムラ」の転用へ治験中。米メルク傘下のMSDは飲み薬の開発をめざしている。富士フイルムホールディングスも一度は承認が見送られたインフルエンザ薬「アビガン」を再び治験にかけている。
治療薬の開発競争を主導するのは米国だ。米国の治験データベースには3千件以上が登録されている。既存薬の転用のほか、人の幹細胞を使用した治療薬などもある。コロナから回復した人の体内にある中和抗体を人工的につくった抗体医薬は効果が高いとして、特に開発が活発な領域だ。
英調査会社エバリュエートによると世界で治験中の治療薬候補は約400。米国は半数超の242を占める。欧州は107。日本は15のみだ。
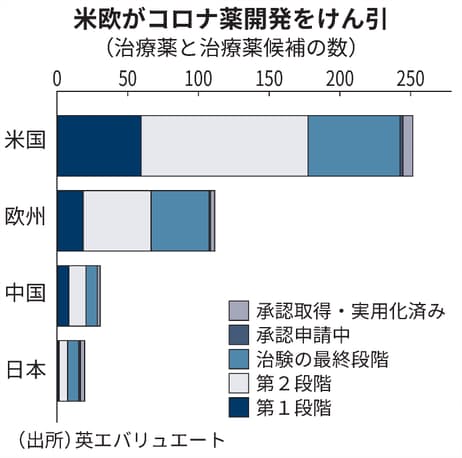
ただ、治療効果が証明された薬剤はまだわずかだ。米国でも使用許可が出ているのはレムデシビルをはじめ、抗体医薬や免疫抑制薬など7種類のみ。欧州も治験や審査を急ぐが、現時点では使用許可が下りているのはレムデシビルだけだ。
開発品目は多いのに使用できる薬剤が少ないのは、変異ウイルスの拡大により治験で有効性を証明できないケースが相次いでいるのが一因だ。英アストラゼネカは6月、抗体カクテル医薬品の治験で発症予防効果を証明できなかったと発表。メルクも4月に抗炎症薬の開発中止を表明した。
米国で緊急使用許可が出ていたイーライ・リリーの抗体医薬「バムラニビマブ」と「エテセビマブ」を併用する治療法も、変異ウイルスに対して有効性が低いとバムラニビマブの使用が停止された。変異ウイルスへの対応に苦戦している。
ワクチンの接種拡大とともに、治療薬がひとつでも増えることが、今なお猛威を振るうウイルスの克服に欠かせない。